环状RNA作为新发现的RNA分子,从诞生之日起就是光环加身,屡屡登上Science、Nature、Cell等高 分期刊。2019年环状RNA共发表SCI论文885篇,较2018年增长约20%,其中大于10分的文章约60篇,是2018年的3倍左右。2019年关于环状RNA的国自然审批金额高达8000多万,环状RNA的火热程度可想而知。2020年国自然还未公布,但是小编预测环状RNA如果还是集中在吸附microRNA的ceRNA机制上,可能会造成专家审美疲劳,影响中标率。环状RNA海绵机制并不是唯 一的环状RNA参与调控的机制。近期近期多篇关于环状RNA机制研究,揭示了环状RNA在肿 瘤方向的研究进展。
发表杂志:Molecular Cancer
影响因子:15.302
发表日期:2020.09.07
研究方法:RIP-seq,RIP-qPCR,荧光素酶验证等
文章链接:《Circular RNA CDR1as disrupts the p53/MDM2 complex to inhibit Gliomagenesis》
抑ai基因p53的失活对胶质瘤的发病机制至关重要,尤其是多形性胶质母细胞瘤(GBM)。MDM2是p53的主要负调节因子,与p53结合形成稳定的复合物来调节其活性。迄今为止,尚不清楚p53/MDM2复合物的稳定性是否受环状RNAs的影响。 本文发现CDR1as与p53蛋白存在结合,CDR1as的表达随着胶质瘤分级的增加而降低,它是胶质瘤(尤其是GBM)生存率的一个可靠的独立预测因子。CDR1as通过一种独立于miRNA海绵的机制,通过防止p53蛋白泛素化来稳定p53蛋白。CDR1as直接与MDM2结合所必需的p53 DBD结构域相互作用,从而破坏p53/MDM2复合物的形成。由DNA损伤诱导,CDR1as可以保持p53功能并保护细胞免受DNA损伤。值得注意的是,CDR1as在体外和体内抑 制肿 瘤生长,但在p53缺失或突变的细胞中几乎没有影响。
CDR1as不是充当miRNA海绵,而是通过直接结合到其DBD区的p53来限制MDM2相互作用,从而起到抑ai作用。 因此,CDR1as结合会破坏p53 / MDM2复合物,从而阻止p53泛素化和降解。CDR1as也可能感知DNA损伤信号并与p53形成保护性复合物以保留p53的功能。 因此,CDR1as耗竭可能通过下调神经胶质瘤中p53的表达来促进肿 瘤发生。 我们的结果进一步拓宽了我们对环状RNA的作用和作用机理的理解,尤其是CDR1as的作用,并可能为有效的神经胶质瘤治 疗开辟新的治 疗途径。
发表杂志:Molecular Cancer
影响因子:15.302
发表日期:2020.09.07
研究方法:全转录组测序,qPCR,质谱等
文章链接:《CircRNA inhibits DNA damage repair by interacting with host gene》
去调控的环状RNA与ai症的发生和治 疗耐药有关。然而,环状RNA的功能研究大多集中在可能的miRNA或蛋白质结合上,而更多的环状RNA对肿 瘤宿主基因DNA的潜在调控尚不清楚。
本文发现在外周血中环状RNA比其宿主线性基因平均表达更高。相对于邻近的正常组织,与宿主基因SMARCA5相反,circSMARCA5在乳腺ai组织中减少了。circSMARCA5的强制表达在体外和体内均可诱导乳腺ai细胞株的药物敏感性。此外,文章证明circSMARCA5可以与其亲本基因座结合,形成一个R环,从而导致SMARCA5的15号外显子的转录暂停。CircSMARCA5的表达导致SMARCA5的下调和截短的非功能蛋白的产生,而circSMARCA5的过表达足以提高对细胞毒性 药物的敏感性。这项结果揭示了一种新的环状RNA调控机制,并为环状RNA可能成为耐药乳腺ai患者的治 疗靶点提供了证据。
发表杂志:Hepatology
影响因子:14.679
发表日期:2020.08.04
研究方法:RNA-seq,RIP,RNA pull down,ChIP,荧光素酶分析,qRT-PCR等
文章链接:《A novel circular RNA, circ-CCAC1, contributes to CCA progression, induces angiogenesis, and disrupts vascular endothelial barriers》
环状ENA(circRNAs)和细胞外囊泡(EVs)与多种恶性肿 瘤有关。本文旨在阐明胆管ai(CCA)细胞和EVs中失调的circRNAs的功能和机制。用CircRNA微阵列技术鉴定CCA组织和EVs中CircRNA的表达谱。采用qRT-PCR检测胆管ai相关环状RNA-1(circ-CCAC1)的表达。通过受试者操作特征曲线、Fisher精确检验、Kaplan-Meier图和Cox回归模型分析circ-CCAC1的临床重要性。分别在CCA细胞和HUVECs中探讨circ-CCAC1和外泌体circ-CCAC1的功能。采用不同的动物模型对体外实验结果进行验证。采用RNA测序、生物信息学、RNA免疫沉淀、RNA下拉、染色质免疫沉淀、测序和荧光素酶报告分析来确定CCA细胞和HUVEC中circ-CCAC1的调控网络。ai性胆汁EVs和组织中Circ-CCAC1水平升高,circ-CCAC1在CCA患者中的诊断和预后价值被认可。对于CCA细胞,circ-CCAC1通过海绵化miR-514a-5p上调YY1来促进细胞的进展。同时,YY1直接与CAMLG的启动子结合,激 活其转录。此外,CCA衍生EVs的circ-CCAC1被转移到内皮单层细胞,破坏内皮屏障的完整性并诱导血管生成。机制上,circ-CCAC1通过将EZH2隔离在细胞质中,从而增加了SH3GL2的表达,从而降低了细胞间连接蛋白的水平。体内研究进一步表明,循环EVs和细胞中circ-CCAC1水平的增加促进了CCA肿 瘤的发生和转移。结论:Circ-CCAC1在CCA肿 瘤发生和转移中起重要作用,可能是CCA的重要生物标志物/治 疗靶点。
发表杂志:Nature Communications
影响因子:12.121
发表日期:2020.08.14
研究方法:RT-qPCR,ChIP等
文章链接:《An inducible circular RNA circKcnt2 inhibits ILC3 activation to facilitate colitis resolution》
Group3固有淋巴样细胞(ILC3)是肠道免疫、炎症和组织稳态的重要调节因子,但ILC3的激 活如何调节仍不清楚。本文发现了一种新的环状RNA(CircRNA) CircKcnt2,它在肠道炎症过程中对ILC3起诱导作用。CircKcnt2基因缺失会导致小鼠肠道ILC3活化和严重结肠炎。在机制上,CircKcnt2作为一种核CircRNA,将核小体重塑脱乙酰化酶(NuRD)复合物招募到BATF启动子上,抑 制BATF的表达,进而抑 制IL17的表达,进而抑 制ILC3的失活,从而促进先天性结肠炎的消退。此外,Mbd3Rag1和CircKcnt2Rag1小鼠在葡聚糖硫酸钠(DSS)治 疗后出现严重的先天性结肠炎,同时BATF的缺失促进结肠炎的消退。综上所述,本文数据支持CircRNA CircKcnt2在调节ILC3失活和解决先天性结肠炎方面的功能。
环状RNA文章研究一览(2020)

一、环状RNA筛选
1.1 环状RNA测序
1.2 全转录组测序(同时检测circRNA、lncRNA、mRNA)
二、环状RNA验证
2.1 qRT-PCR
对选定目标RNA分子可进行qPCR检测服务,包括引物设计与表达鉴定。
2.2 Sanger测序与RNase R酶耐受实验
对选定的环状RNA分子进行反式剪切位点引物设计,扩增后Sanger测序验证环状;使用RNase R酶处理环状RNA分子,验证环状RNA分子稳定性。
三、CircRNA功能机制研究
3.1RIP测序/qPCR
针对目标蛋白抗体把蛋白-RNA复合物沉淀下来,并对复合物上的RNA进行测序或对目标RNA进行qRCR表达分析。
3.2 RNA pull-down+MS/WB/qPCR/RNA-Seq
设计目标RNA生物探针把相应的结合蛋白质与RNA复合物沉淀下来,蛋白质谱检测或WB检测与RNA结合的蛋白。设计目标RNA生物探针把相应的结合蛋白质与RNA复合物沉淀下来,qPCR检测或RNA-seq检测与RNA结合的RNA。
3.3 双荧光素酶报告实验
双荧光素酶报告实验检测两个基因之间的互作。
3.4 病 毒液以及siRNA设计
提供circRNA过表达以及干扰慢病 毒,腺病 毒以及设计siRNA。
四、CircRNA修饰研究
4.1 m6A/m5C/ac4C/m7G/m1A等修饰
针对环状RNA各类修饰进行高通量筛选。
4.2 MeRIP-circRNA-PCR验证
对高通量测序的结果,通过qPCR进行进一步验证。
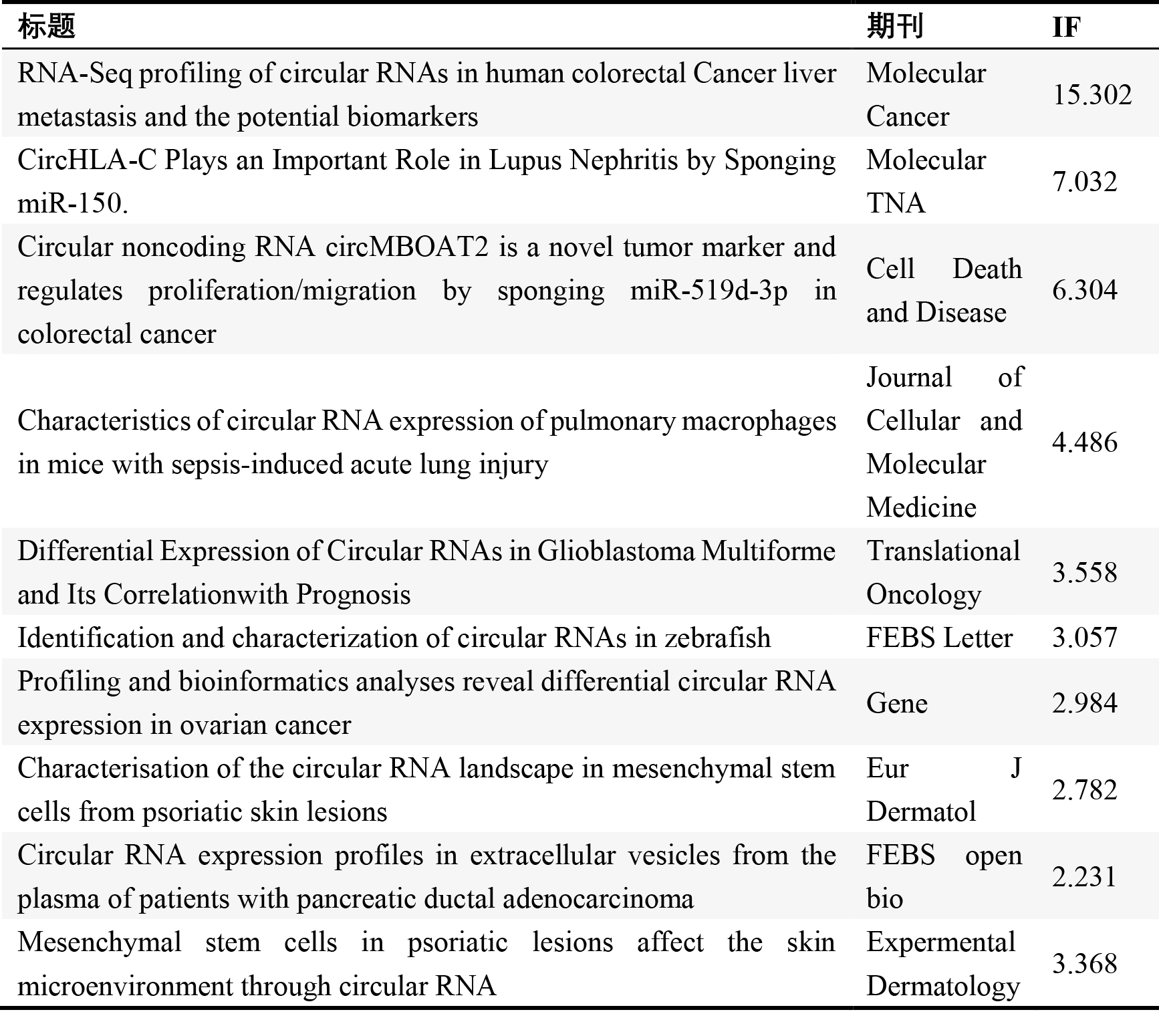
云序客户部分环状RNA相关文章
http://cloudseq.mikecrm.com/YJUc33n
往期回顾
上海云序生物科技有限公司
Shanghai Cloud-seq Biotech Co., Ltd.
地址:上海市松江区莘砖公路 518 号 20 号楼 3 楼
电话:021-64878766
传真:021-64878766
网址:www.cloud-seq.com.cn
邮箱:market@cloud-seq.com.cn
