题目:NFAT1-mediated regulation of NDEL1 promotes growth and invasion of glioma
stem-like cells
期刊:Cancer Research(IF=9.13)
合作技术:细胞系培养和鉴定
研究背景
神经胶质瘤是成人最常见、最难治疗的原发性脑肿瘤,其肿瘤的发生发展与胶质瘤干细胞(GSCs)相关,因此针对这种细胞亚群的研究有利于胶质瘤的临床治疗。鉴于GSCs位于特殊的微环境中,且其诱导和维持机制在很大程度上仍然是未知的,所以揭示促使GSCs迁移侵袭和自我更新的分子机制对于GSCs定向治疗的发展具有重要意义。在本篇文献中,作者深入研究活化T细胞-1的钙反应转录因子(NFAT1)在GSCs中的作用,并报告了一种新的GSCs维持途径,即NFAT1- NDEL1轴(NDEL1是NFAT1下游靶点,神经发育蛋白1)将成为神经胶质瘤治疗策略的重要目标。
研究内容及结果
1. 神经胶质瘤的临床病理特征与NFAT1表达量有关
在前期胶质母细胞瘤中NFAT1系列研究基础上,作者根据TCGA(癌症和肿瘤基因图谱)和Gravendeel(公开的临床数据集)统计发现,神经胶质瘤的间充质亚型中NFAT1表达水平高于其他几种亚型(图1A),且NFAT1表达不仅与干细胞基因(CD44/Vimentin)和间质转化相关基因(REL/LYN/TGFBR2)表达显著相关,也与胶质瘤的预后较缓相关(图1B-1C)。接下来,从新鲜的临床多形性胶质母细胞瘤(GBM)等样本中分离出GSCs,进行细胞系鉴定和富集培养,通过RT-qRCR和免疫荧光染色实验发现,NFAT1高表达与胶质瘤的恶性亚型和GSCs的生长侵袭有关(图1D-1E)。
图1 NFAT1表达与神经胶质瘤的临床病理特征的关系
2. NFAT1影响GSCs的生长和侵袭
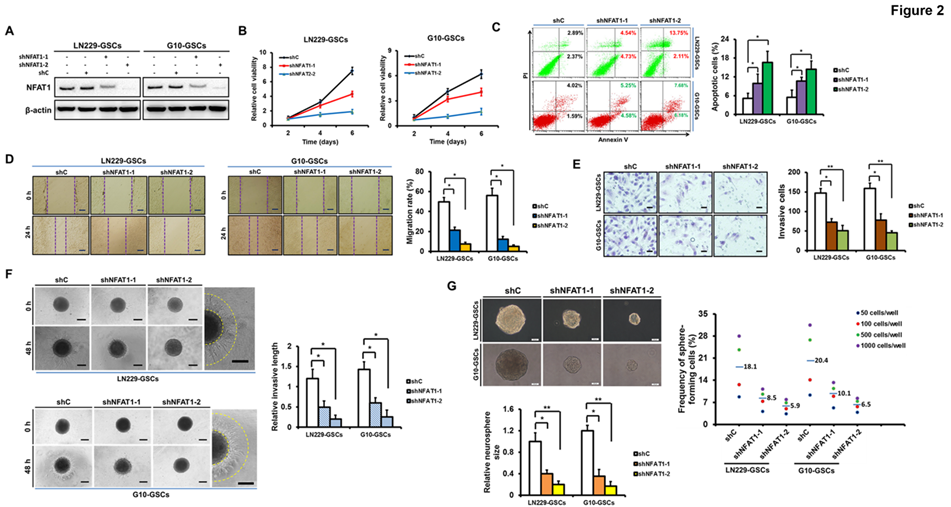
为确定NFAT1对GSCs的生理影响,一方面,采用两个独立的shRNAs分别去转导高表达NFAT1的LN229和G10 GSCs细胞。WB结果证实,其中一个NFAT1 shRNAs (shNFAT1-2) 转导LN229和G10 GSCs后NFAT1减少了80%以上(图2A);体外细胞活性测定和流式分析显示,NFAT1沉默显著地降低GSCs的活性并诱导细胞凋亡(图2B-2C);此外,通过伤口愈合分析、Transwell分析和三维球体侵入分析得到,shNFAT1-2感染GSCs后细胞迁移和侵入行为显著减少,且GSCs球体形成能力下降(图2D-2G)。
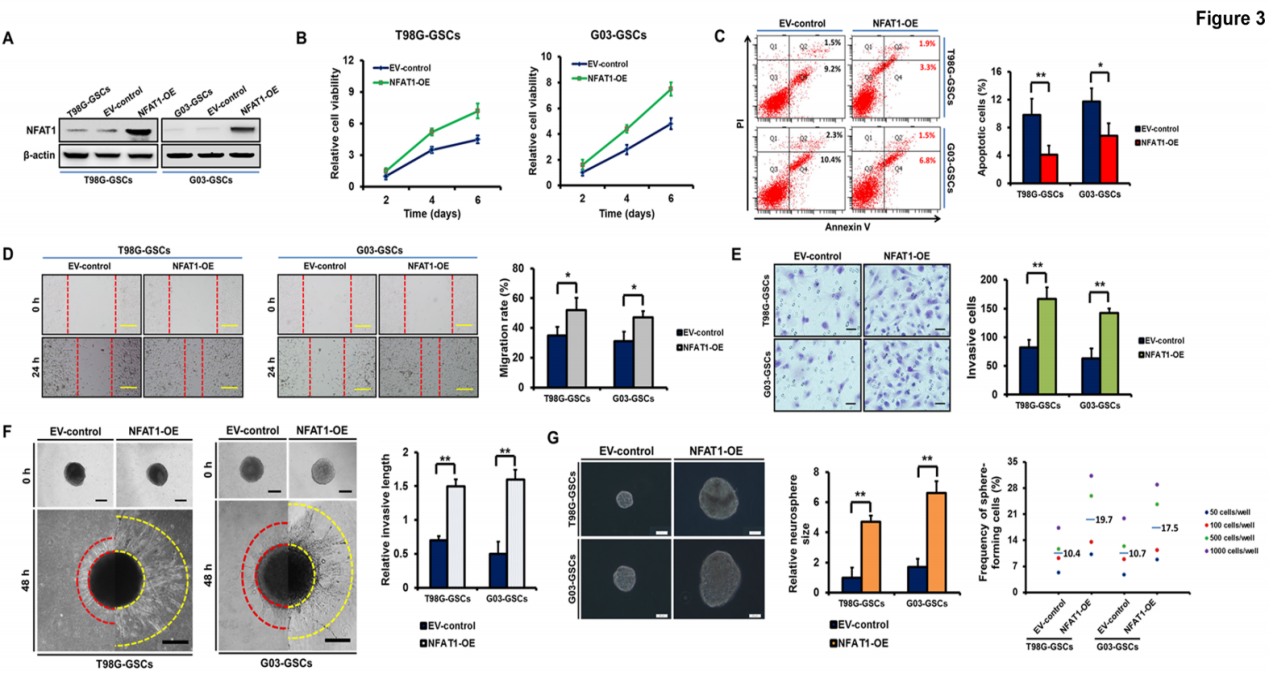
另一方面,在基础水平较低的T98G和G03 GSCs中实现NFAT1过表达(图3A)。通过一系列细胞生物学检测得到,NFAT1过表达显著地增强细胞活性并抑制凋亡(图3B-3C)、增加了GSCs的迁移和入侵(图3D-3F);同时电镜图显示NFAT1刺激GSCs的神经球的形成过程(图4G)。
图2 NFAT1的沉默抑制GSCs的生长和侵袭
图3 NFAT1的过表达促进GSCs的生长和侵袭
3. NFAT1对体内GSCs肿瘤生长具有重要意义
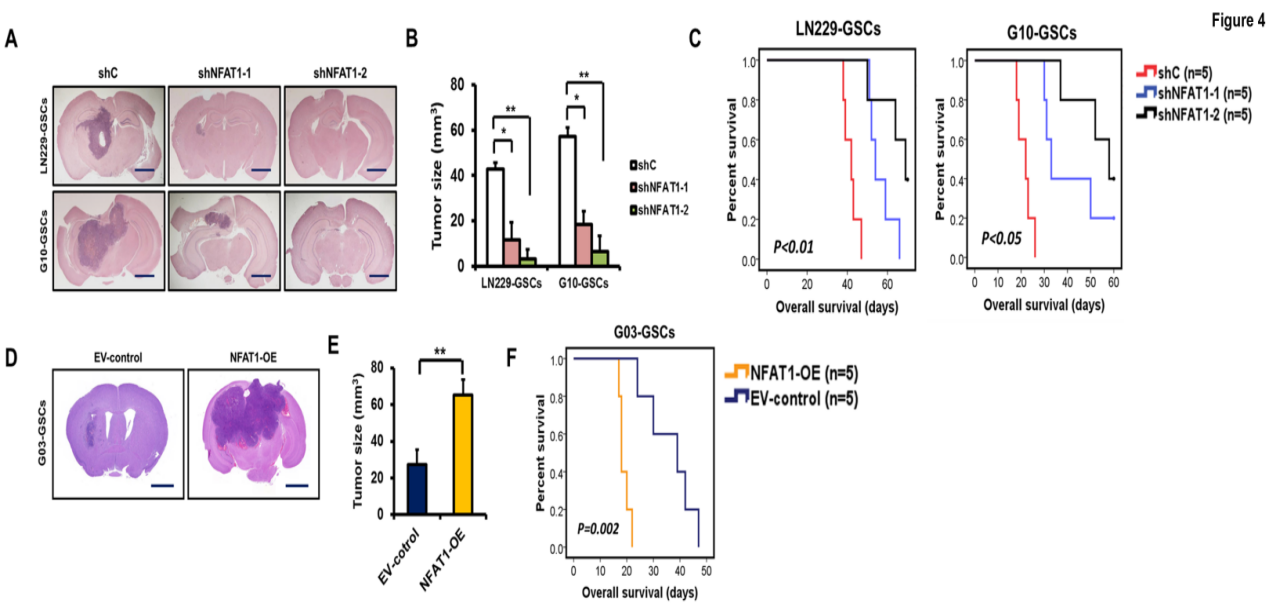
采用颅内小鼠模型,探究NFAT1沉默和过表达对体内GSCs肿瘤生长的影响。大脑切片染色结果显示,与对照shRNA相比,NFAT1的敲除组显著地抑制颅内肿瘤生长(图4A-4B);Kaplan–Meier生存曲线显示T98G和G03 GSCs的细胞生存率增加,进而可推测出NFAT1 shRNAs(shNFAT1-1和shNFAT1-2)将更有效地延长小鼠生存期(图4C-4F)。综上所述,NFAT1在体外和体内都促进GSCs的肿瘤发生。
图4 NFAT1表达影响体内GSCs的生长
4. NDEL1鉴定为NFAT1下游靶基因
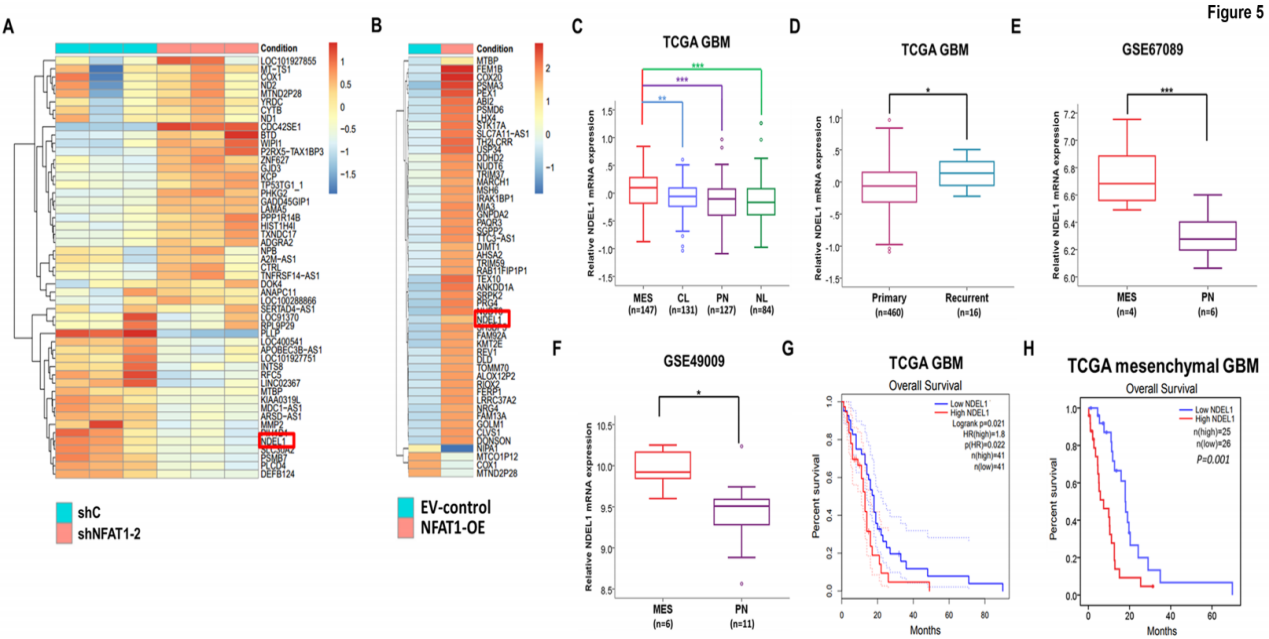
通过开展转录组测序来确定NFAT1的潜在下游靶点,从热图数据中分别初筛出50个NFAT1沉默后下调基因和NFAT1过表达后上调的基因,上述均有可能是NFAT1介导的肿瘤促进基因(图5A-5B);结合TCGA和Gravendel数据集的生物信息学分析,发现NDEL1表达量在复发性GBMs中显著地上调且涉及到间质过渡和干度增加的生理过程(图5C-5D),同时也发现间充质GSCs细胞的NDEL1表达水平明显高于原神经性GSCs细胞(图5E-5F)。与此同时,在挖掘REMBRANDT补充数据集后发现,NDEL1表达不仅与GBMs低存活率相关,还参与胶质瘤的恶性进展。
图5 神经胶质瘤表达与临床病理特征的关联
5. NDEL1由NFAT1转录调节并参与GSCs的发生发展
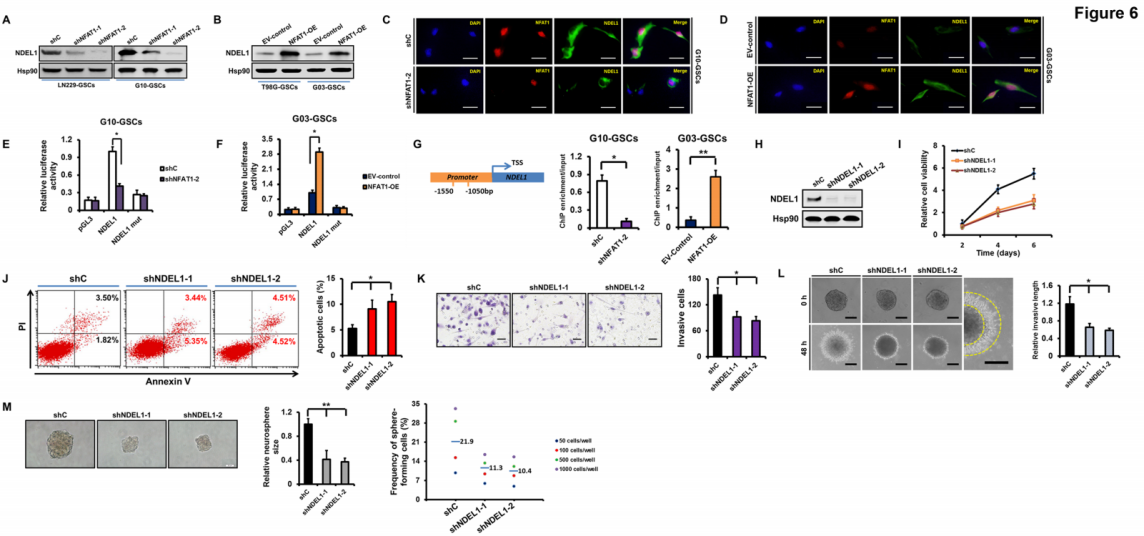
通过蛋白质印迹分析初步验证转录组的数据,NFAT1的沉默显著地降低了NDEL1的表达,且NFAT1的过表达显著地增加了NDEL1的表达(图6A-6B);双标记免疫荧光染色测定出在G10 GSC中NFAT1对NDEL1具有调节作用(图6C-6D);采用荧光素酶分析法检测NAFT1对NDEL1启动子活性的影响,结合ChIP-qPCR芯片分析得出NFAT与NDEL1启动子结合(图6E-6G)。鉴于NDEL1在GSCs生长和入侵中的作用机制尚未确定,由此使用两个独立的shRNAs来稳定地沉默G10 GSCs的NDEL1(图6H);陆续通过WB检测、流式分析、基质凝胶分析、三维球体侵入分析得到,NDEL1的沉默显著降低了G10 GSCs的侵入能力,且在很大程度上抑制了G10 GSCs的自我更新能力(图6I-6M)。
图6 NDEL1由NFAT1的转录调节
6. 在NFAT1沉默的GSCs中NDEL1重新表达可部分恢复肿瘤生长和侵袭
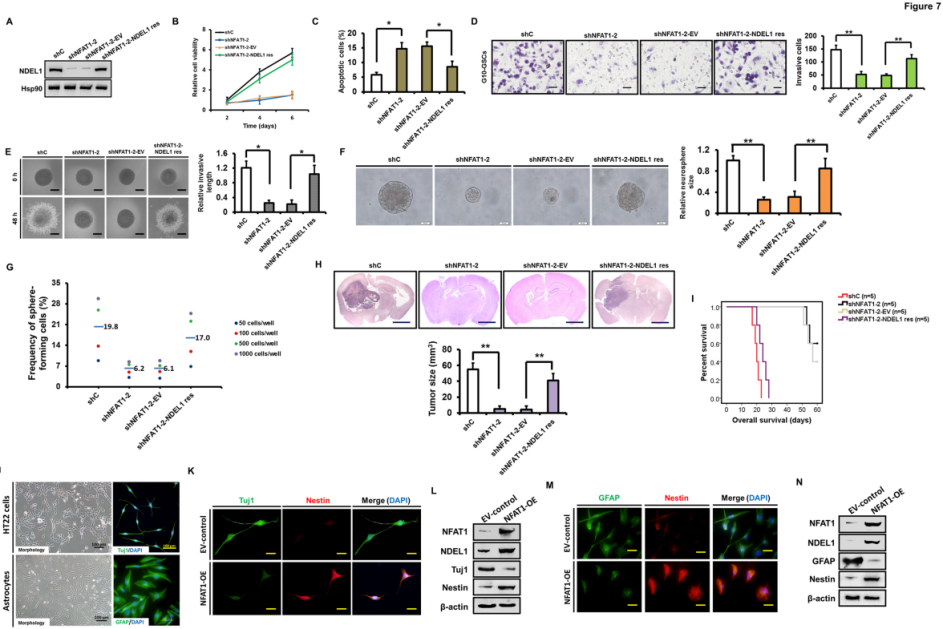
为了进一步研究NFAT1是否通过调节NDEL1表达来部分支持GSCs的攻击行为,作者在FAT1沉默的G10 GSCs中建立NDEL1重新表达的体系(图7A),发现NDEL1重新表达可部分恢复GSCs的生理活性,并减少了NFAT1沉默诱导的细胞凋亡(图7B-7C)。根据基质凝胶分析、三维球体侵入分析和神经球形成检测,得到NFAT1敲除后抑制的GSCs侵袭作用被NDEL1重新表达所挽救(图7D-7E)并恢复了自我更新能力(图7F-7G);此外,大脑切片染色等体内验证实验表明,通过NDEL1重新表达仅部分非完全地缓解NFAT1基因敲除后体内肿瘤生长的抑制效应,也很可能涉及更多的未知途径。
图7 在NFAT1沉默的GSCs中NDEL1重新表达可恢复体外和体内的肿瘤生长
文章小结
本文旨在探讨NFAT1在神经胶质瘤中的调节机制,通过基因敲除和过表达进行初步验证,发现NFAT1表达与胶质瘤的侵袭性表型和生存率相关;RNA测序显示NFAT1的缺失与NDEL1表达关联;结合挽救实验说明NFAT1调控了NDEL1的启动子活性,NFAT1-NDEL1信号上调后激活ERK去提高GSCs干细胞标志物的蛋白水平和细胞分化水平。综上所述,NFAT1通过调节NDEL1去部分控制GSCs的生长和侵袭,以NFAT1-NDEL1轴为靶点可为胶质瘤患者提供较大可能的治疗机会。
解析文献
Jiang Y, Song YF, Wang R, et al. NFAT1-mediated regulation of NDEL1 promotes growth and invasion of glioma stem-like cells. Cancer Res. 2019 Apr 2,DOI: 10.1158/0008-5472.CAN-18-3297.
如何低成本研究空间转录组?看完这篇文章你或许会有答案
(2022-06-02T14:51 浏览数:5405)
【周二晚八点】从位置到功能--空间转录组应用
(2022-05-16T08:59 浏览数:6202)
Cell Reports:利用空间转录组解析哺乳动物精子生成
(2022-04-28T14:54 浏览数:7268)
RNA二级结构调控基因表达的研究现状和进展
(2022-04-21T13:39 浏览数:5336)
Nature: MERFISH绘制小鼠初级运动皮层空间细胞图谱
(2022-04-18T13:24 浏览数:4087)
大自然的恩赐-外泌体药载
(2022-04-08T13:43 浏览数:5666)
【详解】基于图像的单细胞空间分辨转录组学技术
(2022-04-01T11:18 浏览数:9634)
知无不“研”,五分钟带你了解空间分辨转录组学的前世今生
(2022-03-18T14:00 浏览数:6434)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:4936)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:5459)