抗体制备出来之后,需要进一步纯化得到纯的多抗或单抗,既有利于保存也有利于排除杂蛋白对结果的影响。常规用于纯化的材料是腹水和细胞培养上清,而通常经过免疫制备的抗体大多数是IgG的各种亚型,以及少数是IgM,二者电泳条带分步大致如下:
硫酸铵沉淀法
基本原理:高浓度的硫酸铵通过与球蛋白竞争水分子破坏蛋白表明的水化膜,降低球蛋白的溶解性,是分离免疫球蛋白的常用方法,而且不同的免疫球蛋白适宜的硫酸铵浓度也稍有差别,一般用来分离抗体的硫酸铵饱和度在33~50%。
适用于:鼠抗所有亚类、其他种属抗体、任何种属的IgM、IgG、IgA
基本操作:
1.过滤、离心腹水或者培养上清得上清;
2.加入饱和硫酸铵至终浓度45%,静置沉淀蛋白;
3.沉淀蛋白用最小体积PBS或硼酸盐缓冲液溶解,用PBS或硼酸盐缓冲液透析除盐;
4.过聚丙烯酰胺葡聚糖凝胶柱,PBS或硼酸盐(含0.02%叠氮钠)缓冲液洗脱;
5.电泳检测分子量大小,分光光度法测定抗体浓度;
6.抗体保存浓度在0.1-30 mg/mL适宜,-20 ℃保存不超过一个月,避免反复冻融。
亲和层析法
基本原理:基因工程改造的protein A和protein G能特异性结合哺乳动物IgG的Fc区段,将protein A和protein G结合到柱料上,通过亲和层析的方式,可将IgG及其亚类与片段纯化出来。
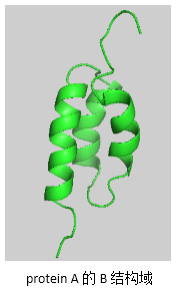
成员介绍:protein A分离自Staphylococcus aureus的细胞壁,分子量42 kDa,由spa基因编码,具有五个同型的免疫球蛋白结合结构域,每个结构域由三个α螺旋构成。
protein A可结合多数免疫球蛋白的Fc段(尤其是人的IgG1、IgG2、IgG4,豚鼠,猕猴,鼠类IgG2a、兔)以及人VH3家族的Fab段。基因工程改造的protein A通常使用大肠杆菌作为表达宿主,表达产物仍含有五个Fc结合结构域。对其结构上的改造主要是为了增加与多孔性材料的偶联性能,也有的改造protein A含有四个或六个同型Fc结合结构域,另外结构域数目较少的protein A能得到更好的抗体纯化效果。
protein G分离自G Streptococcus的细胞壁,分子量65 kDa,由spg基因编码,可结合抗体的Fc段、Fab段以及血清中的白蛋白。基因工程改造的protein G去掉了与白蛋白的结合位点仅仅保留Fc结合结构域,其结合力较protein A更强。
还有一种protein A/G蛋白,是基因工程改造产物,是将protein A的4个Fc结合结构域与protein G的2个Fc结合结构域融合表达得到的。protein A/G结合了二者的特性,能结合人和鼠的IgG所有亚型,不结合鼠的IgA、IgM。
①protein A亲和层析
适用于:人(IgG3除外)、兔、豚鼠、猪的抗体;
基本操作:
1.过滤、离心腹水或者培养上清得上清;
2.调节pH到8.0:腹水以10倍体积pH8.0 PBS稀释、培养上清用pH8.0 PBS透析或强氧化钠调节;
3.过protein A琼脂糖凝胶柱,pH8.0 PBS洗杂;
4.柠檬酸缓冲液洗脱抗体(小鼠IgG1用pH6.5,IgG2a用pH4.5,IgG2b和IgG3用pH3.0),并注意收集管内需加入Tris缓冲液中和滴下的抗体溶液;
5.用PBS透析;
6.电泳检测分子量大小,分光光度法测定抗体浓度。
②protein G亲和层析
与protein A相比,protein G通常情况下在低pH环境下与抗体结合力较强,不过高pH环境下小鼠IgG1和兔、人的抗体在仍可以与protein G结合。
适用于:小鼠IgG1、大鼠抗体、猴抗体、兔抗体、牛抗体、山羊抗体、马抗体、绵羊抗体;
基本操作:
1.过滤、离心腹水或者培养上清得上清;
2.调节pH到5.0:腹水以10倍体积0.1 M醋酸钠(pH5.0)稀释、培养上清以2倍体积0.1 M醋酸钠(pH5.0)稀释;
3.过protein G柱,0.1 M醋酸钠(pH5.0)洗杂;
4.0.1 M甘氨酸(pH2.8)洗脱抗体,并注意收集管内需加入Tris缓冲液中和滴下的抗体溶液
5.用PBS透析;
6.电泳检测分子量大小,分光光度法测定抗体浓度。
③抗原亲和层析法
抗原亲和纯化一般用在多抗的纯化上,这种纯化方式去掉了血清中那些非特异性结合的抗体分子,得到的抗体分子基本上都是能特异性与抗原结合的。抗原亲和纯化需要先将抗原偶联到柱料上,然后通过亲和层析的方式去除非特异性抗体及杂蛋白,得到特异性抗体。通常采用的柱料为溴化氢预处理和N-羟基琥珀酰亚胺预处理琼脂糖凝胶柱料,前者适合偶联大分子,后者适合偶联小分子物质,在实际操作中还是需要根据情况进行选择。
适用于:多抗抗体的纯化,对抗体亚型无限制
偶联基本操作:
1.抗原用0.1 M NaHCO3偶联缓冲液(含0.5 M NaCl,pH8.3)溶解;
2.用1 mM稀盐酸洗涤柱料;
3.混合抗原和柱料,在室温混悬1 h或者4 ℃混悬过夜;
4.用偶联缓冲液洗涤偶联的柱料去掉未偶联抗原;
5.用0.1 M Tris(pH8.0)或1 M乙醇胺(pH8.0)处理偶联柱料2 h以封闭未偶联位点;
6.依次用0.1 M醋酸钠缓冲液(含0.5 M NaCl,pH4.0)和0.1 M Tris(含0.5 M NaCl,pH8.0)洗涤偶联柱料五次,重复此操作三遍。
纯化基本操作:
1.过滤、离心腹水或者培养上清得上清;
2.0.01 M PBS(pH7.4)平衡偶联柱料;
3.抗体样品过柱,0.01 M PBS(pH7.4)洗杂;
4.抗体洗脱液洗脱抗体;
5.用0.01 M PBS(pH7.4)透析;
6.电泳检测分子量大小,分光光度法测定抗体浓度。
随着技术的发展抗体的纯化方法越来越多,例如分子筛层析、离子交换层析等技术也被用于抗体的纯化,在实际运用中需要根据实验目的及其他因素进行方法的选择。
如何低成本研究空间转录组?看完这篇文章你或许会有答案
(2022-06-02T14:51 浏览数:10042)
【周二晚八点】从位置到功能--空间转录组应用
(2022-05-16T08:59 浏览数:10733)
Cell Reports:利用空间转录组解析哺乳动物精子生成
(2022-04-28T14:54 浏览数:12566)
RNA二级结构调控基因表达的研究现状和进展
(2022-04-21T13:39 浏览数:9845)
Nature: MERFISH绘制小鼠初级运动皮层空间细胞图谱
(2022-04-18T13:24 浏览数:8988)
大自然的恩赐-外泌体药载
(2022-04-08T13:43 浏览数:10141)
【详解】基于图像的单细胞空间分辨转录组学技术
(2022-04-01T11:18 浏览数:14142)
知无不“研”,五分钟带你了解空间分辨转录组学的前世今生
(2022-03-18T14:00 浏览数:10863)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:9165)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:9526)